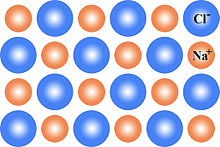
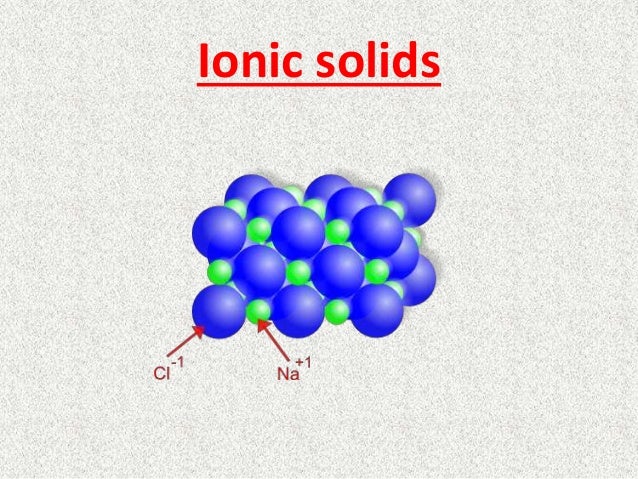
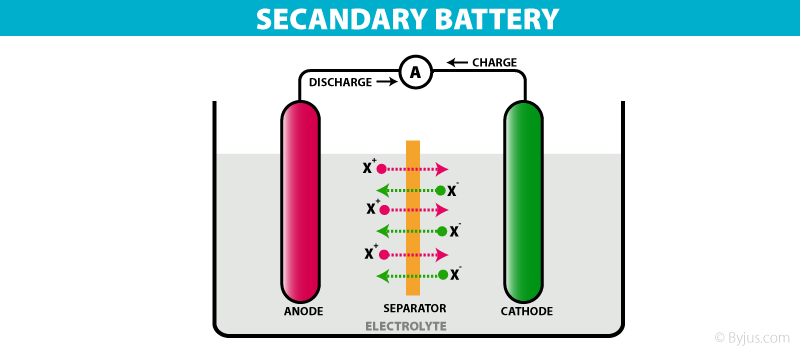
इसमें एनोड Pb का बना होता है। Pb -Sb मिश्रधातु की जाली में महीन चूर्ण किया हुआ स्पंजी लेड भरा रहता है। कैथोड के रूप में Pb -Sb की जाली में Pb₂का महीन चूर्ण भरा होता है। इन कैथोड और एनोड के अनेक प्लेटो को एकान्तर क्रम में व्यवस्थित किया होता है तथा इनके मध्य प्लास्टिक या फाइबर ग्लास शीट लगी होती है। ये सभी प्लेट अम्ल में डूबी रहती है ,जो सख्त रबड़ या प्लास्टिक पात्र से भरा होता है। यहाँ H₂SO₄ विद्युत अपघट्ये का कार्य करता है। बैटरी के निरावेशित होते समय विद्युत धारा देते समय निन्म अभिक्रियाये संम्पन्न होती है।
➤एनोड पर :
Pb + SO₄ → PbSO₄ + 2e-
➤कैथोड पर :
PbO₂ + SO₄ + 4H+ + 2e- → PbSO₄ + 2H₂O
➤सम्पूर्ण सेल अभिक्रिया :
Pb + PbO₂ + 2H₂SO₄ → 2PbSO₄ + H₂O
इस सेल का उपयोग मोटरगाड़ियों में होता है। इस प्रकार के सेल से 2 वोल्ट विद्युत प्राप्त होती है , 3 या 6 सेलो को श्रेणीक्रम में जोड़कर 6 या 12 वोल्ट विद्युत प्राप्त की जा सकती है।
English Translation :
Secondary cell or accumulator cell: Reversible galvanic cells in which high energetic materials react quickly to generate electric current and become active. These substances are activated by external sources and the cell can soon be charged. These are called secondary cells. These secondary cells are also called accumulator cells.
The anode is made of Pb. The finely spongy lead is filled in a mesh of Pb -Sb alloy. The lattice of Pb -Sb in the form of cathode is filled with fine powder of Pb₂. Many plates of these cathodes and anodes are arranged in alternating order and there is a plastic or fiber glass sheet between them. All these plates are immersed in acid, which is filled with a hard rubber or plastic vessel. Here H₂SO₄ acts as electrolyte. When the battery is discharged, a negative reaction occurs while delivering an electric current.

At the anode:
Pb + SO₄ → PbSO₄ + 2e-
At the cathode:
PbO₂ + SO₄ + 4H + + 2e- → PbSO₄ + 2H₂O
Whole Cell Reaction:
Pb + PbO₂ + 2H₂SO₄ → 2PbSO₄ + H₂O
This cell is used in trains. This type of cell provides 2 volts of power, 6 or 12 volts of power can be obtained by adding 3 or 6 cells in series.